1.
Ikatan
Kimia
Ikatan
kimia adalah ikatan yang
terjadi apabila atom-atom suatu unsur bergabung. ikatan kimia tersebut
digunakan untuk membentuk suatu molekul dari dua atom atau lebih.
2.
Pengikatan
dalam Ikatan Ion
Atom
logam (energi ionisasi rendah) cenderung melepaskan elektronnya, lalu diterima
oleh atom nonlogam (afinitas elektron besar). Dari proses transfer elektron
dari atom logam ke atom nonlogam ini akan terbentuk ion positif dan ion negatif
dengan konfigurasi elektron gas mulia yang saling tarik menarik
dengan gaya elektrostatis yang disebut ikatan ionik. Sebagai contoh, dalam
pembentukan senyawa ionik NaCl terjadi transfer elektron dari atom Na ke atom
Cl.
Contoh ikatan ion adalah :
Unsur Na dengan Cl yang membentuk
senyawa NaCl.
11Na : 2,8,1 à Na+
17Cl : 2,8,7 à Cl-
Na+ + Cl- à NaCl
Unsur
Na melepaskan 1 elektron valensinya sehingga konfigurasi elektronnya sama
dengan gas mulia (8), dan unsur Cl menerima 1 elektron pada kulit terluarnya
sehingga konfigurasi elektronnya sama dengan gas mulia (8). Jika unsur
melepaskan elektron, maka unsur tersebut bermuatan positif, namun jika unsur
menerima elektron, maka unsur tersebut bermuatan negatif.
Senyawa yang mempunyai ikatan ion
antara lain :
- Golongan alkali (IA) [kecuali atom H]
dengan golongan halogen (VIIA). Contoh : NaF, KI, dan CsF
- Golongan alkali (IA) [kecuali atom H]
dengan golongan oksigen (VIA). Contoh : Na2S, Rb2S,
Na2O
- Golongan alkali tanah (IIA) dengan
golongan oksigen (VIA). Contoh “ CaO, BaO, MgS
3.
Symbol/Lambang
Lewis
Struktur
Lewis dari suatu molekul adalah cara
menggambarkan bagaimana atom-atom berikatan membentuk molekul dengan
menggunakan penanda seperti noktah atau tanda x untuk mewakili elektron yang
terlibat dalam pembentukan molekul. Elektron yang terlibat ini biasanya hanya
elektron valensi (elektron yang berada di kulit terluar).
Prinsip
dalam menggambarkan struktur Lewis suatu molekul adalah mengupayakan agar
elektron di sekitar atom dalam setiap molekul berjumlah delapan atau mengikuti
aturan oktet. Dengan memiliki elektron sebanyak 8 setiap atom diharapkan
menjadi stabil dengan membentuk ikatan.
Berikut
ini adalah contoh beberapa lambang lewis dalam unsur, molekul atau senyawa.
Lambang Titik
Gambar
struktur lewis unsur N
Gambar
struktur lewis molekul O2
Lambang
Silang
Gambar
struktur lewis unsur F
Gambar
struktur lewis Cl2
Lambang
Bulatan
Gambar
struktur lewis unsur Ne
Gambar
struktur lewis H2O
Lambang
Kombinasi
Gambar
struktur lewis NH3
Gambar
struktur lewis SiF4
Lambang
struktur lewis dapat disederhanakan dengan mengganti lambang titik atau silang
atau bulatan menjadi sepotong garis. Lambang garis pada struktur lewis ini
disebut dengan rumus bangun. Dimana sepotong garis menyatakan
sepasang elektron yang digunakan bersama. Perhatikan aturan berikut
|
1 garis
|
= 1 pasang
elektron ikatan (2 elektron)
|
|
2 garis
|
= 2 pasang
elektron ikatan (4 elektron)
|
|
3 garis
|
= 3 pasang
elektron ikatan (6 elektron)
|
Lambang Garis
Gambar
rumus bangun H2O
Gambar
rumus bangun O2
4.
Ikatan
Kovalen
Ikatan kovalen
adalah ikatan yang terjadi karena
penggunaan pasangan elektron oleh dua atom yang berikatan. Ikatan ini terjadi
oleh unsur nonlogam dengan unsur nonlogam. Senyawa yang berikatan kovalen
disebut senyawa kovalen.
Ikatan kovalen terdiri dari ikatan
kovalen tunggal, ikatan kovalen rangkap dua, ikatan kovalen rangkap tiga dan
ikatan kovalen koordinasi.
Contoh senyawa: HNO3
"ciri-ciri Senyawa kovalen" sebagai
berikut :
a. Mempunyai
titik didih dan titik leleh yang rendah;
b. Berwujud
padat, cair dan gas;
c. Bersifat
isolator dalam keadaan murni.
Atom-atom
nonlogam cenderung tidak ingin melepaskan elektronnya (energi ionisasi tinggi)
dan ingin menarik elektron-elektron dari atom lainnya (afinitas elektron besar)
sehingga terdapat satu atau lebih pasangan elektron yang dipakai untuk berbagi
bersama. Ikatan kimia yang terbentuk dari sharing elektron terlokalisasi antara
atom ini disebut ikatan kovalen. Sebagai contoh, 2 atom H berikatan kovalen membentuk
molekul H2 dan 2 atom Cl berikatan kovalen membentuk molekul Cl2.
Struktur Lewis untuk senyawa kovalen
dapat digambarkan dengan setiap pasangan elektron ikatan (PEI) digambarkan
sebagai satu garis dan pasangan elektron bebas (PEB) digambarkan sebagai
titik-titik. Berikut struktur Lewis untuk beberapa senyawa kovalen.
Ikatan kovalen dengan berbagi satu
pasangan elektron disebut sebagai ikatan kovalen tunggal (ikatan tunggal).
Ikatan kovalen dengan berbagi dua pasangan elektron disebut ikatan rangkap dua,
contohnya CO2. Ikatan kovalen dengan berbagi tiga pasangan elektron
disebut ikatan rangkap tiga, contohnya N2
5.
Menggambar
Struktur
Untuk
bisa menggambarkan struktur lewis suatu molekul atau senyawa, kalian harus
mengetahui terlebih dahulu tentang pasang elektron ikatan (PEI) dan pasangan
elektron bebas (PEB).
|
Pasangan
elektro ikatan atau
PEI adalah pasangan elektron valensi yang dipakai bersama oleh dua atau lebih
atom dalam suatu ikatan kimia. Sedangkan pasangan elektron bebas atau
PEB adalah pasangan elektron yang tidak terlibat dalam pembentukan ikatan
kimia.
|
Berikut
ini adalah langkah-langkah sistematis untuk menggambarkan struktur lewis
molekul atau senyawa.
1.
Tentukan elektron valensi tiap atom dalam molekul
Untuk
bisa dengan mudah menentukan elektron valensi atom bisa dilihat dari golongan
unsur dalamTabel Periodik Modern.
2.
Jumlahkan semua elektron yang ada pada molekul tersebut
3. Tentukan
jumlah pasangan elektron ikatan (PEI)
Nilai
PEI ini menunjukkan jumlah ikatan pada molekul. Untuk menghitung PEI, gunakan
rumus sebagai berikut:
|
PEI
|
=
|
Jumlah
Total Elektron
|
|
8
|
Sisa
elektron pada perhitungan PEI tidak berpengaruh pada PEI, namun digunakan untuk
perhitungan PEB.
4.
Tentukan jumlah pasangan elektron bersama (PEB)
Nilai
PEI ini menunjukkan jumlah pasangan elektron bebas pada atom pusatnya. Untuk
menentukan PEI, gunakan rumus sebagai berikut:
|
PEB
|
=
|
Jumlah
Elektron Sisa pada PEI
|
|
2
|
Untuk
menentukan atom pusat pada struktur lewis suatu molekul atau senyawa dapat
digunakan beberapa teknik sebagai berikut:
Cara
menentukan atom pusat suatu molekul atau senyawa
|
1
|
Dalam
senyawa, atom yang jumlahnya paling sedikit akan menjadi atom pusat
|
|
2
|
Jika
dalam senyawa terdapat dua atau lebih atom yang jumlahnya sama, maka atom
pusat adalah atom yang keelektronegatifannya lebih rendah, atau kalau dalam
satu periode posisinya sebelah kiri dari atom lain, bila segolongan yang
bertindak sebagai atom pusat ada pada paling bawah.
|
|
3
|
Atom
H dan F tidak pernah berperan sebagai atom pusat. Pada asam oksi (asam yang
mengandung oksigen, seperti H2SO4, HNO3, H3PO4,
H2CrO4, dan lain-lain) atom H jarang sekali terikat
pada atom pusat secara langsung, tetapi H lebih sering terikat pada atom O
lebih dahulu).
|
5. Jika ditemui pola yang janggal, bisa disesuaikan dengan kaidah oktet yang paling mungkin
Dalam
menentukan struktur lewis suatu senyawa, tidak harus mengikuti kaidah oktet
(elektron valensi harus 8) atau kaidah duplet (2 elektron valensi), karena pada
beberapa jenis unsur memiliki karakteristik yang berbeda. Untuk itu ada
beberapa pengecualian yang harus diperhatikan dalam menggambarkan struktur
lewis molekul.
Pengecualian
kaidah Oktet-Duplet dalam menggambarkan struktur lewis
|
1
|
B
(boron) maksimal hanya dapat memiliki 6 elektron ketika berikatan
|
|
2
|
N
(nitrogen) pada beberapa jenis senyawa hanya memiliki 7 elektron ketika
berikatan
|
|
3
|
Unsur
yang berada pada periode 3 (seperti P, S, Cl, Br, I) dan unsur logam transisi
berkemungkinan untuk memiliki elektron lebih dari 8 ketika berikatan
|
Berikut
ini adalah contoh cara menggambarkan struktur lewis pada beberapa molekul atau
senyawa.
Contoh
Cara Menggambarkan Struktur Lewis Suatu Senyawa
1.
Cara menentukan struktur lewis senyawa XeO2F2
Tentukan
jumlah elektron valensi pada senyawa XeO2F2 yaitu
sebagai berikut
|
Jumlah
elektron valensi Xe
|
|
=
8
|
|
Jumlah
elektron valensi O2
|
=
2 × 6
|
=
12
|
|
Jumlah
elektron valensi F2
|
=
2 × 7
|
=
14
|
|
Jumlah
total elektron valensi
|
|
=34
|
Kemudian
kita tentukan jumlah PEI dan PEB, dengan rumus yang telah disebutkan di atas,
PEI = 34/8 = 4 sisa 2
PEB = 2/2 = 1
Dari
hasil perhitungan PEI dan PEB di atas berarti senyawa XeO2F2 memiliki
4 ikatan dan 1 pasang elektron bebas di atom pusat. Dan yang menjadi atom pusat
dari senyawa XeO2F2 adalah Xe karena jumlah atomnya
paling sedikit. Kemudian gambarkan struktur lewis XeO2F2 dengan
Xe sebagai pusat dengan 1 pasang elektron bebas dan dikelilingi oleh 2 atom O
dan F.
Kemudian
kita analisis elektron valensi masing-masing atom
Elektron
valensi Xe = 8 (sudah oktet)
Jumlah
elektron bebas =2, jadi sisa elektron Xe untuk berikatan dengan atom lain
adalah 6 elektron
Elektron
Valensi F = 7
Untuk
mencapai kaidah oktet, maka atom F membutuhkan 1 elektron, sehingga 2 atom F
membutuhkan 2 elektron dari Xe. Sisa elektron Xe untuk berikatan adalah 6 – 2
= 4 elektron.
Elektron
Valensi O = 6
Untuk
mencapai kaidak oktet, maka atom O membutuhkan 2 elektron, sehingga 2 atom O
membutuhkan 4 elektron dari Xe. Dan sisa elektron Xe adalah nol.
Pola
struktur lewisnya adalah sebagai berikut
|
PEI
Xe = 6 elektron
|
|
|
|
||
|
memasangkan
|
memasangkan
|
||||
|
Xe
|
→
|
1
elektron
|
1
elektron
|
←
|
F
|
|
PEI
Xe = 6 – 1 = 5 elektron
|
PEB
F = 7 – 1 = 6 elektron
|
||||
|
Xe
|
→
|
1
elektron
|
1
elektron
|
←
|
F
|
|
PEI
Xe = 5 – 1 = 4 elektron
|
PEB
F = 7 – 1 = 6 elektron
|
||||
|
Xe
|
→
|
2
elektron
|
2
elektron
|
←
|
O
|
|
PEI
Xe = 4 – 2 = 2 elektron
|
PEB
O = 6 – 2 = 4 elektron
|
||||
|
Xe
|
→
|
2
elektron
|
2
elektron
|
←
|
O
|
|
PEI
Xe = 2 – 2 = 0 elektron
|
PEB
O = 6 – 2 = 4 elektron
|
||||
Sehingga
gambar struktur lewis untuk senyawa XeO2F2 adalah
sebagai berikut:
Struktur
lewis XeO2F2 apabila disederhanakan dengan rumus
bangun lewis adalah sebagai berikut
2.
Cara menentukan struktur lewis senyawa SO3
Tentukan
jumlah elektron valensi pada senyawa SO3 yaitu sebagai berikut
|
Jumlah
elektron valensi S
|
|
=
6
|
|
Jumlah
elektron valensi O3
|
=
3 × 6
|
=
18
|
|
Jumlah
total elektron valensi
|
|
=24
|
Kemudian
kita tentukan jumlah PEI dan PEB, dengan rumus yang telah disebutkan di atas,
PEI = 24/8 = 3 sisa 0
PEB = 0
Dari
hasil perhitungan PEI dan PEB di atas berarti senyawa SO3 memiliki
3 ikatan dan tidak ada pasangan elektron bebas di atom pusat. Dan yang menjadi
atom pusat dari senyawa SO3 adalah S karena jumlah atomnya
paling sedikit. Kemudian gambarkan struktur lewis SO3 dengan S
sebagai pusat dikelilingi oleh 3 atom O.
Kemudian
kita analisis elektron valensi masing-masing atom
Elektron
valensi S = 6
Karena
tidak ada pasangan elektron bebas maka jumlah elektron S untuk berikatan dengan
O adalah 6 elektron
Elektron
Valensi O = 6
Untuk
mencapai kaidah oktet, maka atom O membutuhkan 2 elektron, sehingga
3 atom O membutuhkan 6 elektron dari S. Dan sisa elektron S adalah nol.
Pola
struktur lewisnya adalah sebagai berikut
|
PEI
S = 6 elektron
|
|
|
|
||
|
memasangkan
|
memasangkan
|
||||
|
S
|
→
|
2
elektron
|
2
elektron
|
←
|
O
|
|
PEI
S = 6 – 2 = 4 elektron
|
PEB
O = 6 – 2 = 4 elektron
|
||||
|
S
|
→
|
2
elektron
|
2
elektron
|
←
|
O
|
|
PEI
S = 4 – 2 = 2 elektron
|
PEB
O = 6 – 2 = 4 elektron
|
||||
|
S
|
→
|
2
elektron
|
2
elektron
|
←
|
O
|
|
PEI
S = 2 – 2 = 0 elektron
|
PEB
O = 6 – 2 = 4 elektron
|
||||
Sehingga
gambar struktur lewis untuk senyawa SO3 adalah sebagai
berikut:
Struktur
lewis SO3 apabila disederhanakan dengan rumus bangun lewis
adalah sebagai berikut
1.
Orde
Ikatan dan Bebarapa Sifat Ikatan
Orde
ikatan adalah jumlah ikatan kimia antara
sepasang atom.
Misalnya, dalam nitrogen diatomik N≡N, orde ikatan adalah 3, dalam asetilenaH−C≡C−H orde
ikatan antara dua atom karbon juga 3, dan orde ikatan C−H adalah 1.
orde ikatan memberikan indikasi stabilitas ikatan. Unsur dengan nilai orde
ikatan 0 tidak dapat ada, namun senyawa dapat
memiliki nilai ikatan 0. Spesi isoelektronik memiliki
bilangan ikatan yang sama.
Dalam molekul yang memiliki resonansi atau
ikatan nonklasikal, orde ikatan tidak perlu bilangan
bulat. Dalam benzena, di mana orbital
molekulterdelokalisasi mengandung 6 elektron pi
di atas enam karbon yang pada dasarnya menghasilkan setengah ikatan pi bersama
dengan ikatan sigma untuk masing-masing sepasang
atom karbon, memberikan orde ikatan yang terhitung sebesar 1.5.
2.
Resonansi
Resonansi atau mesomerisme merupakan penggunaan dua
atau lebih struktur Lewis untuk menggambarkan molekul
tertentu. Struktur resonansi adalah salah satu dari dua atau lebih struktur
Lewis untuk satu molekul yang tidak dapat dinyatakan secara tepat dengan hanya
menggunakan satu struktur Lewis. Tanda panah dua arah menyatakan bahwa
struktur-struktur yang diberikan merupakan struktur resonansi.
Masing-masing
struktur resonan dapat melambangkan struktur Lewis, dengan hanya satu ikatan
kovalen antara masing-masing pasangan atom. Beberapa struktur
Lewis digunakan bersama-sama untuk menjelaskan struktur molekul.
Namun struktur tersebut tidak tetap, melainkan ada sebuah osilasi antara ikatan
rangkap dengan elektron,
saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang
sebenarnya mungkin saja adalah peralihan dari dua struktur resonan. Bentuk
peralihan (intermediet) dari struktur resonan disebut dengan hibrida resonan.
Resonansi
dalam kimia diberi symbol garis dengan dua panah.perhatikan contoh resonansi
berikut :
Pada
ozon, terdapat perpindahan electron antar inti yang dijelaskan dengan anak
panah,perhatikan contoh berikut :
Molekul
atau ion yang dapat beresonansi mempunyai sifat-sifat berikut:
1.
Dapat
dituliskan dalam beberapa struktur Lewis yang disebut dengan struktur resonan.
Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang
bersangkutan.
2.
Di
antara struktur yang saling beresonansi bukanlah isomer.
3.
Masing-masing
struktur struktur Lewis harus mempunyai jumlah elektron valensi dan elektron
tak berpasangan yang sama.
4.
Ikatan
yang mempunyai orde ikatan yang berbeda pada
masing-masing struktur tidak mempunyai panjang ikatan yang khas.
5.
Struktur
yang sebenarnya mempunyai energi yang lebih rendah dibandingkan energi
masing-masing struktur resonan.
3.
Muatan
Resmi dan Seleksi Struktur Lewis
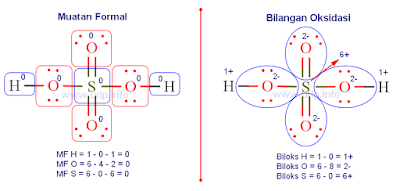
Muatan
formal adalah suatu alat imajinatif
(artifisial/buatan) yang ada dalam benak para ahli kimia yang kemudian
digunakan untuk mempelajari sifat-sifat senyawa. Aslinya dalam molekul itu
tidak ada yang disebut muatan formal ;) . Muatan formal ini digunakan untuk
membantu melacak bagaimana konfigurasi elektron dalam ikatan. Muatan formal
adalah muatan suatu atom dalam molekul atau ion poliatomik jika semua elektron
yang digunakan berikatan itu dibagi rata di antara atom-atom yang berikatan
itu. Muatan formal ini digunakan untuk memprediksi manakah struktur molekul
yang dianggap "terbaik", yang lebih stabil di antara kemungkinan yang
ada. Atom-atom yang berikatan sama dengan nol atau yang paling mendekati nol
ini akan dianggap paling stabil. Secara normal andai terdapat muatan negatif
biasanya akan dimiliki oleh atom yang elektronegativitasnya lebih tinggi.
Aturan
perhitungan muatan formal suatu atom dalam molekul: 1) elektron yang berupa
pasangan elektron bebas suatu atom menjadi milik atom itu sendiri, 2) elektron
yang berupa pasangan elektron berikatan dibagi 2 sama rata, 3) total muatan
formal molekul netral harus sama dengan nol, total muatan pada ion poliatomik
sama dengan muatannya.
Muatan formal = elektron valensi - Σ
elektron bebas - ½ Σ elektron berikatan
atau dapat disederhanakan
Muatan formal = elektron valensi - Σ elektron bebas - Σ ikatan di sekitar atom
atau dapat disederhanakan
Muatan formal = elektron valensi - Σ elektron bebas - Σ ikatan di sekitar atom
Contoh penerapan perhitungan muatan formal pada ion NCS-:
Sama halnya dengan muatan formal, bilangan oksidasi ini juga suatu alat imajinatif (artifisial/buatan) yang ada dalam benak para ahli kimia yang kemudian digunakan untuk mempelajari sifat-sifat senyawa terutama reaksi reduksi oksidasi. Aslinya dalam molekul itu tidak ada yang disebut biloks ;) .
Biloks ini digunakan untuk membantu melacak bagaimana konfigurasi elektron dalam reaksi yang rumit di mana elektron mengatur ulang untuk pembentukan ikatan baru.
Bilangan oksidasi atom = Σ EV − Σ ES
Σ EV = jumlah elektron valensi atom
Σ ES = jumlah elektron yang dapat dimiliki atom ketika berikatan dengan atom lain di sekitarnya.
Σ EV = jumlah elektron valensi atom
Σ ES = jumlah elektron yang dapat dimiliki atom ketika berikatan dengan atom lain di sekitarnya.
Jumlah elektron valensi suatu atom dapat dilihat pada golongan unsur pada tabel periodik unsur atau dari konfigurasi elektron bila diketahui nomor atom-nya.
Jumlah elektron yang dapat dimiliki atom ketika berikatan dengan atom lain di sekitarnya ditentukan dengan aturan atom yang memiliki elektronegativitas tinggi lebih "berhak" untuk "mengambil" elektron untuk dimilikinya sedangkan bila atom yang berikatan itu sama maka elektron dibagi 2 sama banyak.
Contoh penerapan perhitungan bilangan oksidasi pada ion NCS-:
Gambar struktur Lewis H2SO4 (asam sulfat)
Gambar struktur Lewis H2O2 (hidrogen peroksida)
Gambar struktur Lewis OF2 (oksigen diflorida)
Gambar struktur Lewis S2O32- (anion tiosulfat)
4.
Ikatan
Kovalen Koordinasi
Ikatan
Kovalen Koordinasi adalah ikatan
yang terbentuk dengan cara penggunaan bersama pasangan elektron yang berasal
dari salah satu atom yang berikatan [Pasangan Elektron Bebas (PEB)], sedangkan
atom yang lain hanya bisa menerima pasangan elektron yang digunakan bersama. katan kovalen di mana salah satu atomnya mendonasikan pasangan
elektron yang dimilikinya. Pada ikatan kovalen koordinasi, pasangan elektron
ikatannya hanya berasal dari satu atom, bukan dari kontribusi bersama kedua
atom yang berikatan. Contoh:
5.
Molekul
Polar dan Elektonegativitas
Elektronegativitas paling sederhana didefinisikan sebagai daya tarik dari sebuah
unsur pada elektron itu untuk berbagi ikatan. Ketika dua atom berbagi elektron,
seperti tarik tambang ada di antara mereka. Elektron akan menghabiskan lebih
banyak waktu di sekitar unsur yang lebih elektronegatif, dan semakin besar
perbedaan elektronegativitas, akan semakin tidak merata pembagiannya.
Sebaliknya, Jika dua unsur memiliki elektronegativitas yang mirip, mereka akan
berbagi elektron dengan cara yang kurang lebih sama.Ikatan kimia di mana
elektron-elektron digunakan bersama secara setara dan merata, seperti pada Cl2 dan
N2, disebut sebagai ikatan kovalen nonpolar. Ikatan di mana salah
satu atom memiliki daya tarik elektron (elektronegativitas) yang lebih tinggi
terhadap elektron-elektron ikatan dibanding atom lainnya, sehingga terjadi
pembentukan dipol (pemisahan muatan negatif dan muatan positif), seperti pada
HF, disebut sebagai ikatan kovalen polar. Ukuran kepolaran dinyatakan
dengan besaran yang disebut momen dipol (μ). Semakin besar
momen dipol, semakin besar kepolarannya. Satuan momen dipol adalah debye (D),
di mana 1 D = 3,34×10−30 Cm.Jika dua muatan berlawanan dengan
besar muatan sama Q+ dan Q− terpisah dengan jarak r, maka momen dipolnya adalah
hasil kali Q dan r:
μ = Qr




























0 komentar:
Posting Komentar